ここからは、現在の守屋研の2つのメインプロジェクト/テーマについて解説する。まずは、タンパク質暗黒面プロジェクトである。コロナ期間のストレスからか、守屋は2021年頃からふざけたネーミングを次から次へと考えるようになった。そのほとんどはすでに忘れたが、SHOTAなどは論文として残った(Namba G3 2022)。「タンパク質暗黒面(Protein Dark Side)プロジェクト」もその1つである。このプロジェクトが何を目指しているかというと、「タンパク質を過剰発現したときに起きる増殖阻害のメカニズムを知りたい」ということでる。別の言い方で「タンパク質の毒性発揮のメカニズム」とか、「タンパク発現量を制約・拘束するメカニズム」などと言ったりもする。後者がどういうことかは追って説明する。
gTOW6000プロジェクトにより同定された115種類の量感受性遺伝子
gTOW6000プロジェクト(第3部)から得られた最大の成果は、115種類の量感受性電子(Dosage Sensitive Genes:DSGs)が同定されたことである。これはDSGの機能と繋がりを表した1枚のフィギアにまとめた。余談だが、守屋がCharlie Boone氏の研究室を訪ねたときに、彼らの最大の成果である遺伝子相互作用ネットワークを黒背景のパネルとして廊下に展示しているのをみて、真似して黒背景にしたのが下図で、同様に自分が作ったいくつかの図をパネルにして研究室に飾ってある(誰にも響いていないようだが)。
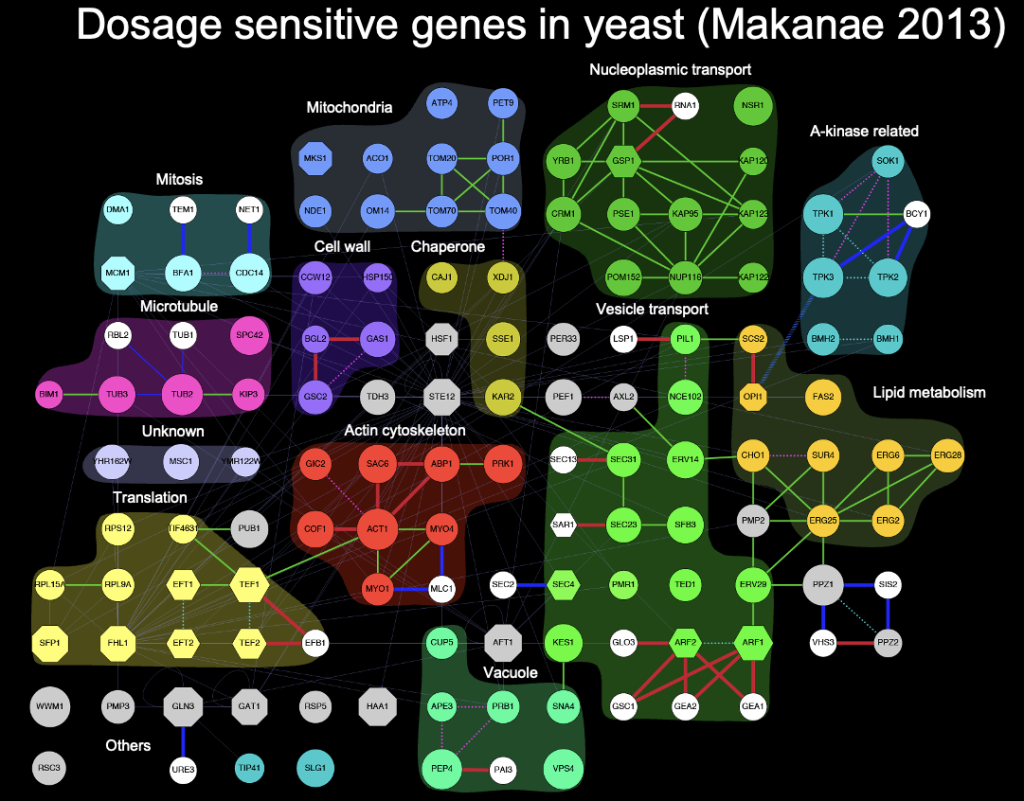
さて、gTOW6000論文(Makanae Genome Res. 2013)では、これらのDSGが生じるメカニズムとして、化学量不均衡とタンパク質負荷があることを明らかにした。第3部でも述べたように、gTOW6000論文が出たあと一端終わった感があって、すぐにこの延長の実験に手を出そうという気にはなっていなかった。そうはいっても、研究を続けるためには研究テーマを考えなければならない。第4部のいろいろなgTOWや第5部の量補償プロジェクトなどは、gTOW6000からは少しズレた路線になる。この停滞感を打破したのは、Charlie Boon氏からのオファーだった。それがどんな意味を持つオファーだったかを知るために、まずは出芽酵母のゲノムワイドな過剰発現実験の歴史について知らなければならない。
出芽酵母でのゲノムワイドな過剰発現コレクションはgTOW6000が初めてではない
gTOW6000は、端的に言ってしまえば、出芽酵母(Saccharomyces cerevisiae)の遺伝子すべてを過剰発現できるプラスミドコレクションである。こういうのを「ゲノムワイドコレクション」と言う。出芽酵母のゲノムワイドな過剰発現コレクションは、gTOW6000が初めてではない。1996年に酵母のゲノムが決定されてから、遺伝子破壊株の作成とともに過剰発現のプラスミドライブラリーも作られ始めた(ランダムなゲノム断片が組み込まれたゲノムライブラリーはもっと古くからある)。最も代表的なものは、Sopkoのライブラリーである。これは、Charlie Boone氏とBrenda Andrews氏のグループから2006年に発表された(Sople Mol. Cell 2006)。そういう意味で、gTOW6000は初めてのライブラリーではない。一方で、Sopkoはプロモーター置換、gTOW6000は多コピー化+gTOWなので、そもそも調べられることが違う。このあたりの主張の仕方について論文書くときに失敗したのは守屋のHPに書いた。ごく簡単に言うと、自分たちの新規性を主張したいがために先行研究をディスって怒りを買った。
酵母の過剰発現実験には長い歴史があることを知っていて、Boone&Andewsのような大御所に対抗して、自分たちのgTOWが割り込んでいけるという自信もなかった。だから、「コピー数限界」とか、「量感受性遺伝子」という独自の文脈でやっていた。それはそれで異数性の研究と関係して、Angerika Amon氏という別の大御所にぶち当たってしまうのだが、それはまた別の話。
守屋、過剰発現を語る
結果としては、「プロモーター置換とgTOWは相補的な関係にある」というのが正しい。その主張の機会を与えてくれたのがCharlie Boon氏だった。「Molecular Biology of the Cell(MBoC)でQuantitative cell biologyの特集号を組むから、お前、Perspective投稿しないか?」というのが彼からのオファーだった。2つの過剰発現の違いは、まさにその定量性にある。それを守屋が書いて良いというオファーだと理解した。実際には、書きたいことがあれば書いて投稿すれば良いだけなのだが、オファーは強い後押しになる。しかも、Charlieからの後押しだ。そういうわけで、それまでいろいろ考えていた過剰発現の実験系の違いや過剰発現が引き起こす悪影響などを全てもりこんで総説を書いた(Moriya MBoC 2015)。
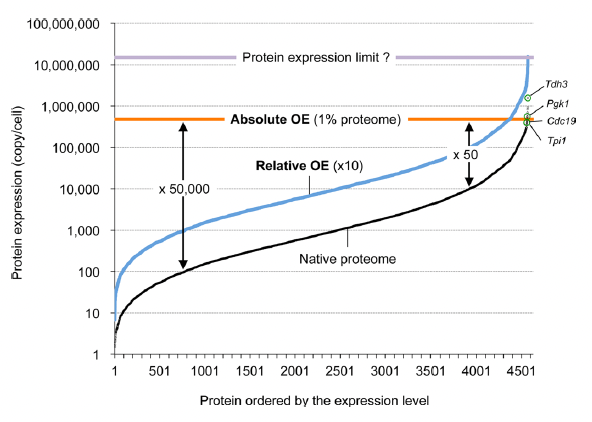
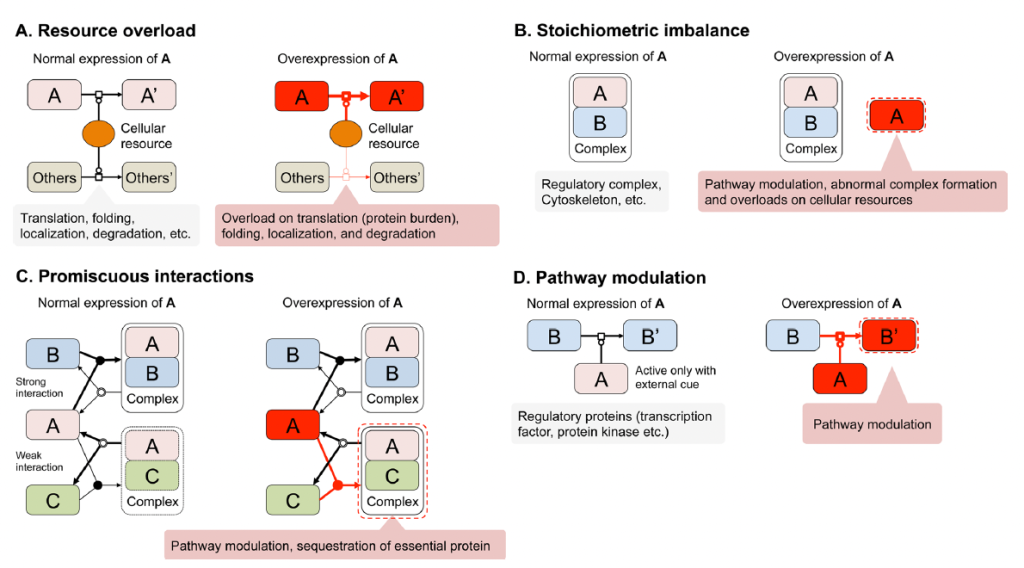
この総説により、守屋は大手を振って「過剰発現を研究している」と言えるようになった。長く研究していると不思議なことが起きる。過剰発現について語るべきは、本来はSopko論文の著者だったはずだ。だが、彼らはいろいろなプロジェクトの1つとして過剰発現をやっており、この研究に誰かの「肝」が入っていたわけではない。その後、Sopko論文の著者が誰か独立して、「過剰発現ラボ」を作っていれば守屋と戦っていたかも知れない。だがそうははらなかった。過剰発現についてこだわり続けて研究しているうちに、他の人が勝手にいなくなり、守屋は過剰発現研究の山の上に1人で立っていた。大御所のAngerika Amon氏は亡くなってしまったので、現在最大のライバルはAudrey Gasch氏ということになるだろう(守屋の片思いの可能性大だが)。
もちろんCharlieからのオファーにちゃんと応えちゃんと仕事をしたからそうなっているわけで、自然にそんな状態になったわけではない。研究をしているとこういう経験が時々ある。予期しないタイミングでオファーが振ってくる。受けるか受けないかは自分次第。でも、それに応えると未来がどっと開くことがある。これまで何度かそんな経験をしてきて、「これは開くオファーだ」というのがだいたい分かるようになってきた。それを、「光るオファー」と呼ぼう。
ちなみに、守屋はその後、Charlieの研究室でサバティカルをすることになる。その時、そこの研究員に、「あなたの論文を読んで初めて過剰発現の定量性が理解できた。とても良い論文だった」と言われた。これはとてもうれしかった。なお、この論文書いたときの感想みたいなものが守屋のHPに残っていて、上記と似たようなことが書いてある。
「量感受性のメカニズム」から「過剰発現による増殖阻害のメカニズム」へ
そういうわけで、テーマの呼び方が、「量感受性を生むメカニズム」から「過剰発現による増殖阻害のメカニズム」へと変わった。呼び方が変わっただけのように見えて、ここには大きな違いがある。より一般性な言葉を使うことで、やれることが増えたのだ。量感受性だと、「わずかに変動させたときに影響が出る」というニュアンスが拭えない。過剰発現とすれば、わずかかどうかは問わなくて良い。「ものすごく過剰発現したときに悪影響が出る」というところまで研究の範囲にできる。
量感受性だと、「ロバストではない/脆弱な制御」が対象だが、過剰発現だとロバストネスのさらに先までが対象になる。つまり、このときにgTOWがロバストネス解析の枠組みから飛び出してしまった。守屋研の研究がシステムバイオロジーに見えないという批判があるとすれば、そのせいだろう。だが、ここまでの文脈が理解できる人には自明のように、守屋研のテーマは、いずれにせよ「発現パラメーターの範囲がどうやって決まっているのか?」の延長であり、これは生命をシステムとして理解するシステムバイオロジーの問いそのものなのだ。
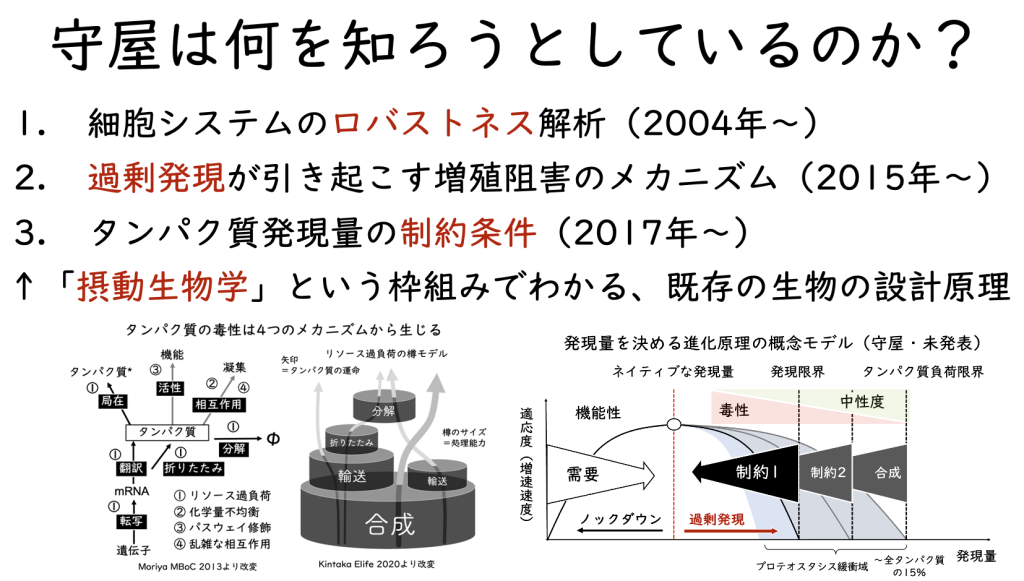
この辺の変遷は、2017年11月のさきがけ懇話会で発表している。実際には、さらに「プロテオームの拘束条件」へと進んでいる。同じ内容を今は、「タンパク質発現量の制約条件」と呼んでいる(これは後に解説する)。

過剰発現による増殖阻害の4つのメカニズムに迫る
さて、そうなってくると、上記の総説に書いた「過剰発現による増殖阻害の4つのメカニズム」が存在する事をgTOWを使った概念実証で示すことが守屋研のISSUEとなった。Stoichiometry imbalance(化学量不均衡)は3つの論文で示した(Kaizu PLoS Genet. 2010, Moriya Mol. Syst. Biol. 2012, Makanae Genome Res. 2013)。Resource overload(リソース過負荷)の一部(タンパク質負荷)はgTOW6000論文にある(Makanae Genome Res. 2013)が、その延長で何か実験ができるだろう。Pathway modulation(パスウェイ修飾)は、活性を失わせた変異体の過剰発現を調べれば良い。Promiscuous interaction(乱雑な相互作用)は、凝集体の毒性を調べれば分かるだろう。それらが以下の基盤Bの課題として現れている。
- 酵母の量的均衡遺伝子が作るネットワークの全容解明(基盤B 2011 – 2013)
- 化学量不均衡を避けるメカニズムの解明(基盤B 2014-2016)
- 過剰発現により輸送リソースの過負荷を引き起こすタンパク質の体系的解析(基盤B 2017-2019)
- 変異タンパク質の限界発現量から探る過剰発現による増殖阻害のメカニズム(基盤B 2020-2021)
- 新たな限界発現系gTOW2.0で解き明かす発現制約メカニズムの全体像(基盤B 2024-2027)
挑戦的萌芽ではリソース過負荷により焦点を絞った2つの課題が採択されている。
- 酵母におけるプロセス負荷の原理の解明(挑戦的萌芽 2013-2014)
- タンパク質の限界発現量から探る細胞の処理能力(挑戦的萌芽 2018-2020)
これらの中で、gTOW6000後の新機軸となり現在も続いているものが、リソース過負荷・タンパク質負荷の研究である。リソース過負荷やタンパク質負荷がどのようなものかについては、「細胞のタンパク質発現リソース配分とタンパク質発現キャパシティ」(化学と生物 2016年)に日本語での初めての解説がある。
蛍光タンパク質を使ったリソース過負荷の研究
リソース過負荷を簡単に言うと、たくさん作られたタンパク質がタンパク質を処理するプロセス(合成・分解・局在など)に負荷をかけることで起きる増殖阻害のことである。特に、合成系のみに負荷をかける場合を「タンパク質負荷」と呼んでいる(これは守屋と他のグループで見解が異なる場合もあるー後述する)。もっと簡単に言うと、「無駄なタンパク質をたくさん作ることで細胞がしんどくなる」のがタンパク質負荷だ。
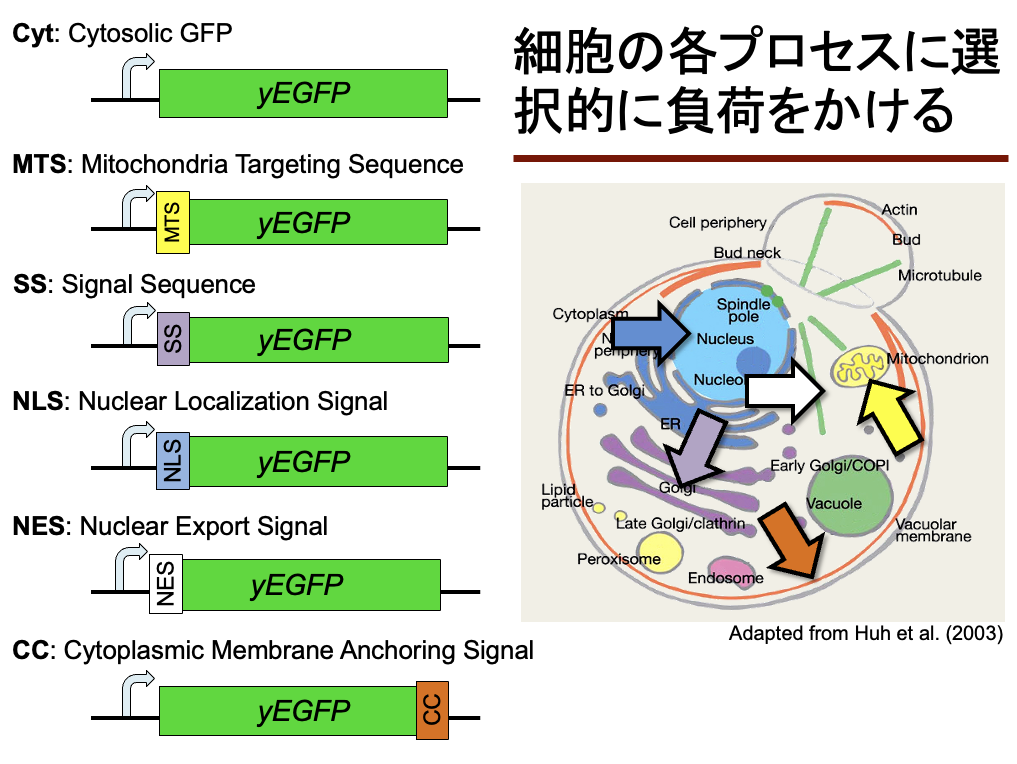
現在まで守屋研で続く、蛍光タンパク質(特にGFP)を使ったリソースタンパク質負荷の研究はgTOW6000論文から始まる(Makanae Genome Res. 2013)。発現量の高い遺伝子が量感受性になる理由がタンパク質負荷によるものであることと、ORFをGFPと置換することで示した。

この時、GFPに分解シグナル(ODC degron)を付けるとより増殖阻害効果が高まる。つまり、タンパク質がたまることが増殖阻害の原因ではなく、合成(と分解)プロセスへの負荷が増殖阻害の原因だということを示せた。この時使ったのは、強化型GFP(EGFP)で、「酵母細胞内では機能をもたない無害なタンパク質」のつもりでこれを使った。この時はこれからEGFPの無害さを調べる研究に発展していくとは思ってもいなかった。
さらにこの研究の発展として、細胞内の局在化による過負荷の調査を行おうと考えた。その研究成果は2012年の酵母遺伝学フォーラムで発表している。タイトルは、「タンパク質の過剰に対して、細胞内の各プロセスは異なった頑健性を持っている」というとで、この時はまだロバストネス(頑健性)にこだわってはいたようだ。
リソース過負荷の論文発表
2011年末頃から始まったこの仕事は、かなりの紆余曲折があって、2016年にようやく初めての論文がでた(Kintaka Sci. Rep. 2016)。この論文についての解説と産みの苦しみについては守屋のHPに論文発表直後にまとめてある。
今この時点で、もう一度なぜこの仕事が大変だったかを振り返るとすれば、局在化の過負荷をGFPとgTOWで調べようとした瞬間に、とんでもなく開けた未知の知識空間に乗り込んでしまったからなのだと分かる。当時はそれに気づいていなかった。その知識空間で自分たちの仮説ー局在への過負荷の存在を証明しようとして、いろいろな「未知」にぶつかりそれをクリアーしていった。それは「自分たちの無知」から来るものだと当時は思っていたが、結局は人類の無知だった。・・・誰も知らない、やったことの無いことをやったのだ。そうではあるのだがやはりこの論文には複雑な思いがある。もっと良いところに出せたという思い(実際、海外の研究者から言われたことがある)。まあ、どんな論文にもそういう思いは付随している・・・それらの思いの発生源はここには書けないので、知りたい人は飲み会で守屋に聞いて欲しい。
この時、守屋研の研究は細胞生物学に向かった。システムバイオロジーと細胞生物学が結合し、「システム細胞学」となった。異分野コアに守屋研があったときの研究室の名前となる。
リソース過負荷の研究の1つのブレークスルーは、またしてもCharlie Boone氏である。2015年にCharlieから共同研究のオファーがあり(この内容は後述する)、金高令子氏(当時大学院生、現在東洋紡)がトロント大学でSynthetic Genetic Array(SGA)の解析をおこなった。リソース過負荷の制限因子となる遺伝子を同定しようというプロジェクトで、その一部はeLife誌に2020年に掲載された(Kintaka eLife 2020)。この解析でようやく自分たちがやろうとしていることが間違っていないことが分かったし、輸送の制限因子も同定できた。
なお、「一部」と書いたのは解析データの半分くらいはまだ発表できずに残っている。データを得たときになんとかして論文化までもって行く、「データを成仏させる」能力は研究者にはとても大事、というよりは必須である。キャリアの面からだけでない。研究にはお金がかかる。そのお金は誰かから託されたものだ。日本なら研究費の大半は血税である。それに応えるために研究者はデータをなんとかして論文にしないといけない。それが例え当初目指していたように行かなかったとしてもだ。「Publish or Perish」の真の意味はここにあると守屋は思う。このデータもなんとかして論文化までもってもって行きたい。
リソース過負荷の樽モデル誕生
このリソース過負荷のプロジェクトはいろいろと研究費に繋がった。
- 酵母におけるプロセス負荷の原理の解明(挑戦的萌芽 2013-2014)
- 酵母の生合成キャパシティーの拡大(新学術領域公募 2013-2014)
- 過剰発現により輸送リソースの過負荷を引き起こすタンパク質の体系的解析(基盤B 2017-2019)
- タンパク質の限界発現量から探る細胞の処理能力(挑戦的萌芽 2018-2020)
この過程で出てきたのがリソース過負荷の樽モデルで、2016年に挑戦的萌芽の申請書を書いているときにできた。2017年度に一度不採択となり2018年度採択となった。
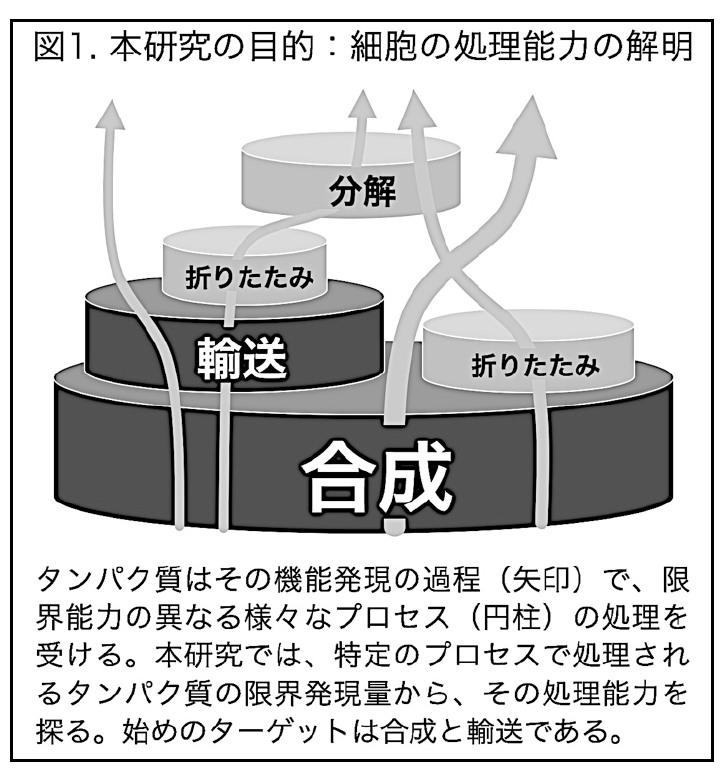
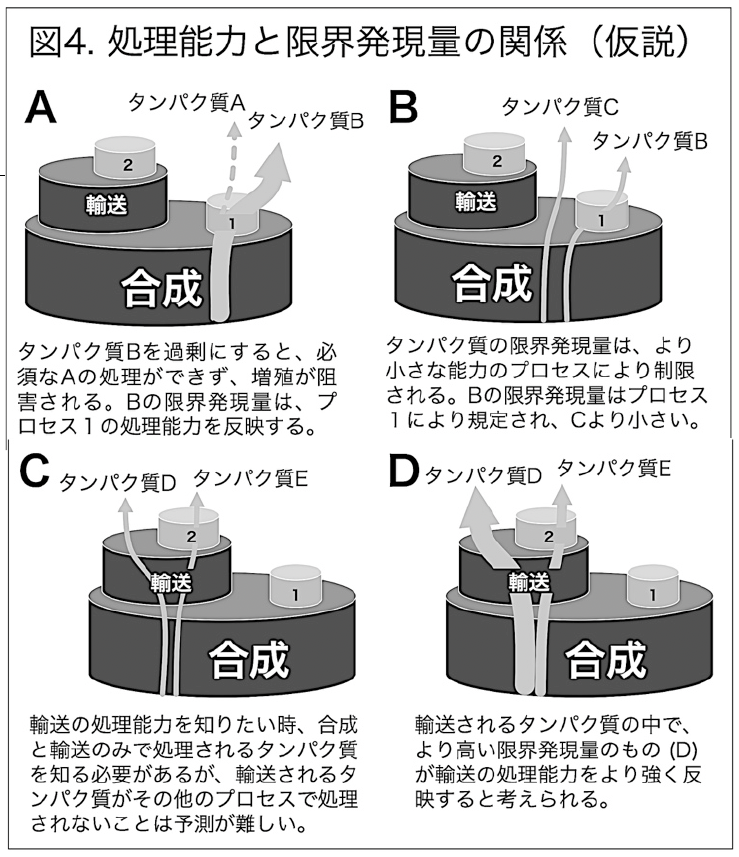
挑戦的萌芽 2018−19の申請書より。リソース過負荷の樽モデルの説明。
この「モデル」はこの後プレゼンで度々使うようになる。学会としては、2016年11月の細胞を創る研究会がはじめてだったようだ。守屋は2016年から3年間、断続的に在外研究(海外に滞在して研究すること)をやっていて、2017年はドイツ(ハイデルベルグ大学:Michael Knop)、スペイン(バルセロナのEMBO:Ben Lehner)、スウェーデン(チャルマース工科大学:Jens Nielsen)、デンマーク(コペンハーゲン大学:Matteo Barbaris)でセミナーをした。その時に中心の話題がこのリソース過負荷の樽モデルだった。
英語の論文にする前に生体の科学に書いた日本語の解説記事「生体内のタンパク質の発現量はどのような原理で決まっているのか? -プロテオームの拘束条件を探る」に登場し、Kintaka eLife 2020に英語論文としてはじめて登場する。
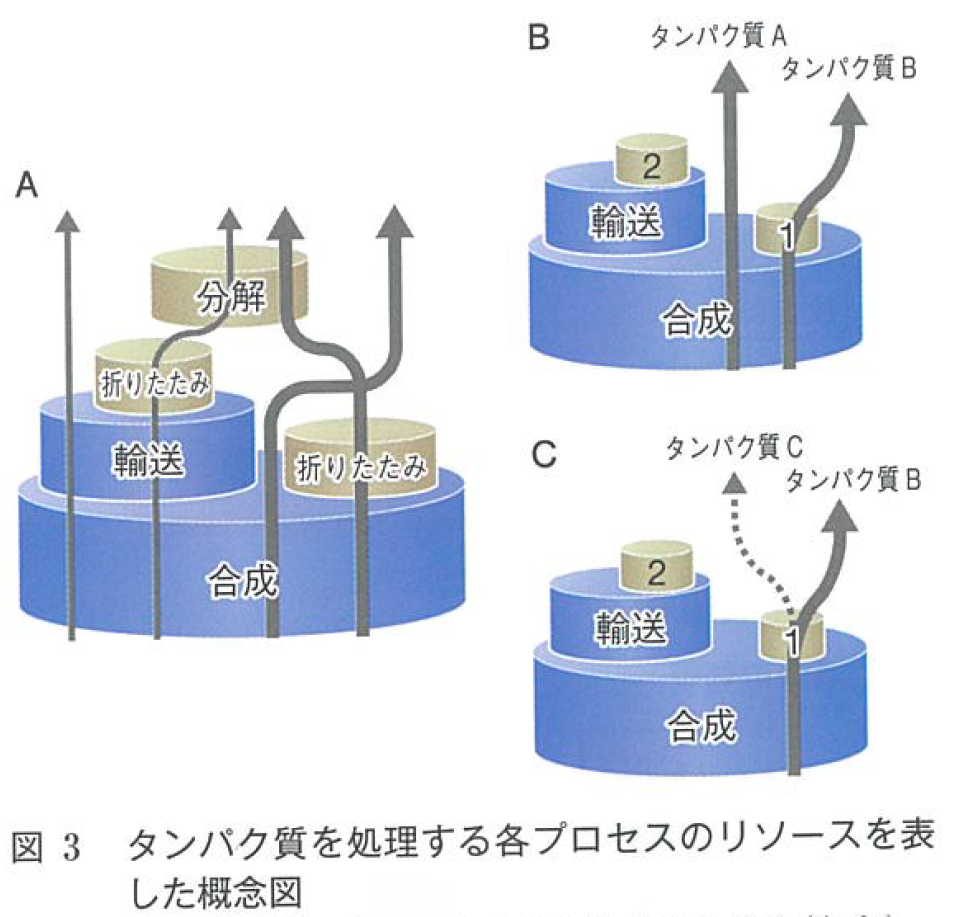
守屋としては自分たちが言いたいことをうまく具現化した概念図だと思っているのだが、基本的に何の反響もない。おかしいとも言われないけれど、これで合点がいったとも言われない。まあ、自分がプレゼンするときにはこれがあることでずいぶんプレゼンしやすくなったのでそれで良いと思うことにする。
「無害なタンパク質を探す」という挑戦
この思いつきは、2014年11月の細胞を創る研究会だったと記憶している。「タンパク質の発現量の限界を決める要素はなにか?」という主にgTOW6000とリソース過負荷の初期のデータを発表し終わって、他の演者の発表を聞いているときだった。「解糖系に関わる酵素タンパク質の発現限界を測ろう。コピー数限界ではなくて、タンパク質量の限界をSDS-PAGEで測ろう。」というのがその時のアイデアだった。2014年12月1日にこの実験を始め、結果を初めて発表したのが2015年3月の農芸化学会だから、我ながら相当のスピードだ。とはいえ当時、よく実験をしてくれるバイトの山本君(ヤンマー)がいたからというのもある。
Kintaka Sci. Rep. 2016では、gTOW関係の仕事としては初めてタンパク質量の限界を測定している。「タンパク質負荷」を起こすほどタンパク質を発現させるとSDS-PAGEでも簡単に定量できるので、そもそも大量に発現できる解糖系酵素なら同じようにSDS-PAGEで見えて、その量も測れるだろうと目論んでいて、実際そうだった。この実験は、2015年の4月からラボに来た江口優一氏が引き継ぎ、シミュレーションやメタボローム解析なども加えてeLifeに発表した(Eguchi eLife 2018)。なお、プロジェクトの初期のアイデアは江口氏のものでなかったことから、彼は「この仕事は自分のものじゃない」と言うことが多かった。だが、統計処理に耐えられるよう複数試行をしたのも彼だし、シミュレーションやメタボローム解析、発見の仮説検証をやったのも彼で、この仕事は江口氏がいなければここまで成長しなかっただろう。
この仕事は、Ben Lehner氏にレビューが回ったようで、彼のグループからInsightとして研究を紹介してもらえた(Bolognesi & Lehner eLife 2018)。上述したように、この前に彼の研究所でセミナーをしていて仕事を知ってもらえていたのも大きかったのだろう。
だいぶ現在に近づいてきたこのエントリーだが、まだまだ書かなければならない歴史がある。だがなかなかすんなり書けそうにないので一旦ここまでとする。書きたいのは以下の内容である。
無害なタンパク質(だけ)がタンパク質負荷を起こす、のだよ。
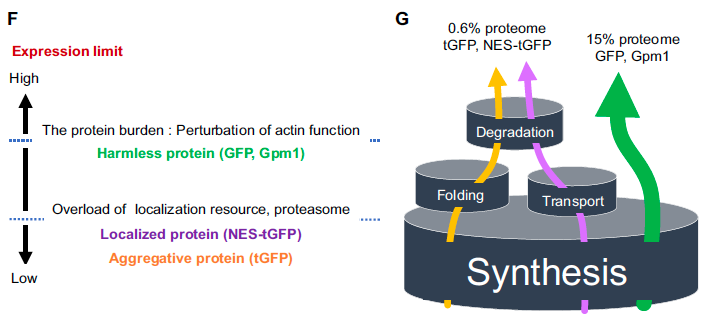
リソース過負荷のモデルの最も重要な点は、「無害なタンパク質のみがタンパク質負荷を起こす」と言うことである。これは、なかなか分かってもらえない。というか、そのためにはまず、「タンパク質負荷」の定義から始めなければならない。いや、むしろ「タンパク質負荷とは無害なタンパク質が起こす増殖阻害のメカニズムであり・・・」と、ロジックが循環してしまう。
さらに話がややこしいのは、タンパク質負荷の解釈が守屋とは全然違う研究者もいるところなのだ。とあるタンパク質負荷の論文(Namba G3 2022だったと思う)を投稿したとき、レビューアの1人に、「タンパク質負荷とは、余剰に発現したタンパク質が引き起こす増殖阻害のことで、そのメカニズムはタンパク質によってさまざまだ」といってリジェクトされたことがある。「おいおい、それじゃあ、あなたにとっては化学量不均衡もパスウェイ修飾も乱雑な相互作用も全部タンパク質負荷なのかよ」、とあきれてしまった。もしそういう定義で「タンパク質負荷」を使っているならそれでもいい、ならばそこを分解して1つずつ見せてやる必要がある。
・・・結局のところ、「タンパク質負荷(Protein burden / Prorein cost」を定義するところから話を始めなければならない、ということだ。だが、それはそれですごく大事なことだ。自然科学における概念の理解には、統一された言語と数理化が必要である(これを「公理化」というのかも知れない)。タンパク質負荷も最終的には公理にならないといけない。それを最終的にどうやったら良いのか、守屋自身目処は立っていないが、自分がそうだと思うものを説いて、徐々にコンセンサスを得ていくのが今必要なことだろう。
タンパク質負荷のSGA、スクープされる
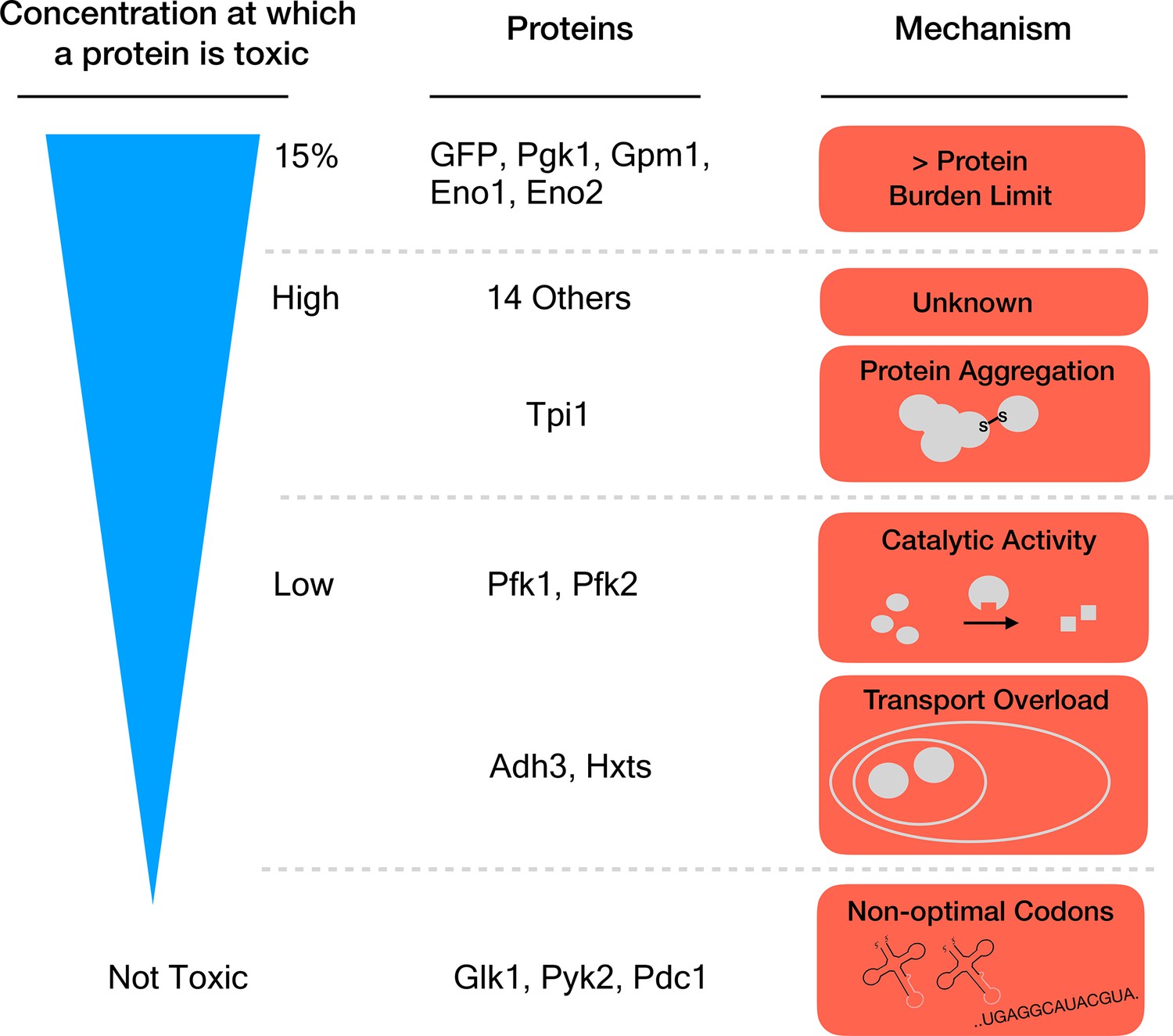
上記に関連する事として、「タンパク質負荷のSGAのスクープ事件」というのがある。酵母を用いたタンパク質負荷の研究では、2つのライバルによる論文がある。1つ目は、「The Cost of Protein Production(Kafri Cell Rep. 2016)」これは私たちがgTOW6000論文を出して、リソース過負荷の論文を作っている頃に発表された。Naama Barkai氏という著名なシステムバイオロジストの研究室からの論文で、この後もかなりの影響力を持った(今も持っている論文である)。守屋研ではタンパク質負荷のその先をやっているつもりだったので、良い参考論文にさせてもらう程度で考えていた(この考えは後に間違っていたことが分かる)。
もう1つは、「Hsp70-associated chaperones have a critical role in buffering protein production costs(Farkas eLife 2018)。こちらは大変に、やっかいな論文、というか、いわゆるスクープだった。この業界での「スクープ」とは、自分達が研究している内容が他の研究者によって先に論文として発表されることを指す。上の方で書いた金高氏がトロントでやっていたリソース過負荷のSGA解析(Kintaka eLife 2020)と内容が被っていたのだ。ただ、私たちがEGFPをはじめとして、リソース過負荷を調べる多数のGFP修飾体の過剰発現でSGAをやっていたことに比べ、FarkasらはEVenus(強化型の黄色蛍光タンパク質)の過剰発現でSGAをやっていて、ずいぶんと規模は小さかった。逆に言うと、そんなスケールが小さくてもeLifeなのだから、私たちがやっているのはずいぶん先に進んでいるな、と言う感想も持った。また、同じようなことをやってタンパク質負荷の原理を調べようとしている研究者がいることは、少しうれしくもあった。あまりにも孤独だと自分がやっていることが正しいのか分からなくなるものだ。
それはさておき、この論文はスクープであったことよりももっとやっかいな問題が含まれていた。まず、タンパク質負荷を起こすとされる彼らのEVenusでのSGAの結果が、私たちのEGFPのSGAの結果とずいぶん、と言うか全然違っていた。SGAでは相互作用がある遺伝子の変異体が得られるのだが、彼らが得た変異体のリストが私たちと全然違う。「違う」となると、それを無視して私たちの論文が発表できるわけがない。結局、膨大なSGAのデータを読み解いて、その原因が特定できた。(あまり大きな声では言えないが)、Farkasらのデータはイマイチで、自分たちのデータが優れてることが逆に分かった。
あと、もう1つやっかいだったのは、「タンパク質負荷」についての考え方。彼らは、タンパク質負荷は、シャペロン系に影響を及ぼすと結論していた。しかし、私たちの考え、上記に書いたように、プロテオスタシスなど余計なことに影響を及ぼさないのがタンパク質負荷のはずなのだ。つまり、シャペロン系に影響が出るという時点で、それはもうタンパク質負荷ではない。つまり、「タンパク質負荷を調べる」という目的で使ったyEVenusは、無害なタンパク質ではなかったことを意味する。
いずれにせよこのライバルの仕事のおかげで、私たちは逆に自分たちのSGAの持つ意味や価値を理解することができた。ライバルの存在は大事、ライバルがいるから自分たちも高みに達することができる。Kintaka eLife 2020はライバルに2年の後れをとったが、そのおかげで当初よりも遙かにSolidな仕事として世に放つことができた。そして、無害なタンパク質のみがタンパク質負荷を起こすんだぞという、「リソース過負荷の樽モデル」をここで発表することもできた。
EGFPは無害なタンパク質ではなかった
さて、Farkasらの論文(Farkas eLife 2018)は、EVenusが無害なタンパク質ではないことを示唆していた。私たちは、自分たちが使っていたEGFPは無害だと信じていた。これが正しくないというのが分かる事件(?)があった。EGFPを大量発現している酵母は、異常な細胞伸長を示したのだ。いろいろ調べてみるとEGFPは細胞内で凝集(SHOTA)を作り、熱ショック応答を引き起していた。伸長するのはシステインを持っているせいで、凝集の理由はタンパク質の折りたたみエラーだということがわかった。折りたたみを改善してシステインをなくしたmoxGFPでは大量発現しても、凝集体は見られず細胞伸長もしなかった(Namba G3 2022)。つまり、EGFPも無害ではなく、私たちが期待するタンパク質負荷以外の悪影響を細胞に与えていたのだ。Kintaka eLife 2020では、3つつないだEGFP(3xGFP)が細胞内で凝集体を作ってタンパク質分解系にストレスをかけることを示していた。これは、大きなタンパク質だから生じるストレスなのかと考えていたが、実際にはEGFPが折りたたみエラーを起こしやすいタンパク質だからだった。そのあたりは、3xGFPの性格を調べた論文で発表した(Namba JCS 2024)。このあたりの仕事は現在にいたる「無害なタンパク質を探す世にも奇妙な物語」として続いている。
GFPに毒性を足すーN10GFPプロジェクト
Kintaka Sci. Rep. 2016で示したように、無害なタンパク質のGFP(正確にはEGFP)に局在シグナルという負荷になる配列を付けたら軒並み発現限界が下がる。局在シグナルは大抵そんなに長くないペプチド。それを付けるだけでGFPの毒性が変わるのを検出できる。これは、GFPといういろいろなタンパク質の中でも特にたくさん発現できるタンパク質を、gTOWで限界ギリギリまで発現させているからこそできるのだろう。そもそもギリギリを攻めているので、GFPへのちょっとした加工を感受性高く検出できるのだ。ちょっとした毒性の違いを拡大/拡張して検出できるのだ。このことを強く主張したことはないが、多分間違っていない。いずれちゃんと理論的な証明をしたいところではある。
今進行中のPolyXプロジェクトがそれをうまく利用したものなのだが、その前身となるプロジェクトがN10GFPプロジェクトだった。これは2013年12月に始まったプロジェクト。その頃守屋は、「ラボに入ろう」をモットーとしていて、自分でいろいろ実験していた。その中の1つである。手を動かすといろいろアイデアが浮かんでくるものだ。今はラボに守屋のベンチがないけれど、チャンスがあれば再開したい(学生には迷惑という説もある)。
さて、このプロジェクト、非常に簡単に言うとN末端に10アミノ酸のランダムな配列を付けて、その時のGFPの毒性や発現がどう変わるかを調べるというものだ。現在は、Deep Mutational Scanning(DMS)と言って、取り得る配列全部調べるというのが 主流だが、そういう技術と金がなかったので、手作業で96の変異体を拾って調査した。96変異体しかないけれど、発現量が変わったり毒性が変わる変異体がとれたりした。特にシステインがもたらす毒性がここで見えてきて、これは後の論文で役に立った。あとは、「有効フロンティア」と同じ概念で、「Protein burden frontier」が見えていることも示した。
ある時、AIMS Biophysicsという聞いたこともない雑誌から、「GFP特集号をやるから論文書かないか?」と招待され、別件の論文を準備していたがそっちは結構面白くなってきて、こういう雑誌に投稿するのはもったいないだろうと言うことで、代わりに投稿したのがこの仕事である(Moriya AIMS Biophys. 2020)。こういう招待はMDPI系から山のように来るが、一度嫌な目に遭って無視している。今なら投稿はしていないだろうけど、単著でこういう論文を書くのも面白くはあった。
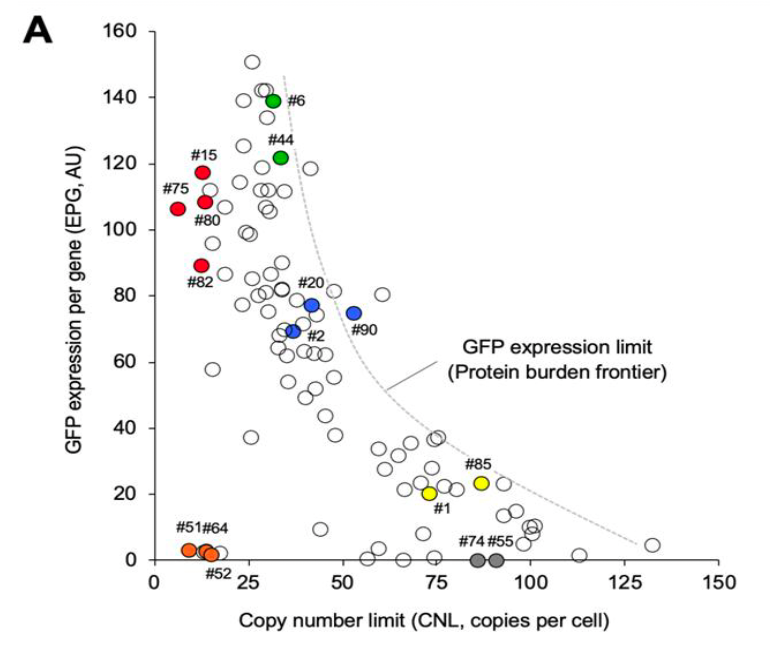
ちなみにこれを本気でやろうと2014年に挑戦的萌芽の申請をしたが、落ちた(下図)。同じコンセプトの実験の論文がその後しばらくして高インパクトジャーナルに掲載されており、見る目のない審査員にムカついたものだ。まあ、守屋の実力不足なのだよ。ただ、この手のプールドライブラリーの提案は後のADOPTで花開く。
タンパク質の暗黒面を知らしめたい
こういう歴史で続いているのが、「タンパク質の暗黒面プロジェクトである」。新学術「マルチファセットプロテインズ」領域の公募にだして2度とも落とされた。マルチファセットではタンパク質の良い面だけに注目していたので、「いやいや、悪い面も理解しないとタンパク質のことは分かったことにならないよ」、という思いを込めて以下のロゴを考えたのだが、思いは通じなかった。
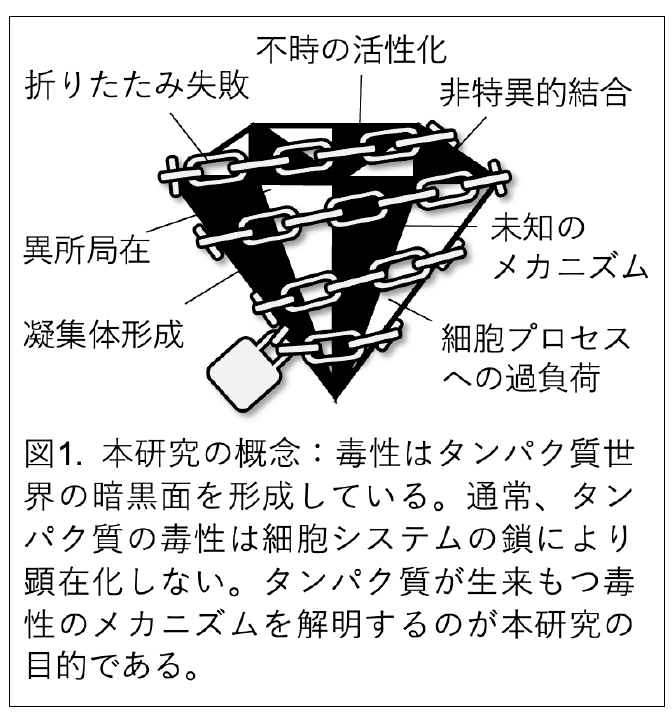
しかし、世にタンパク質の暗黒面を分からせるまで守屋(研)は挫けない。今はおおよそ以下の3つのテーマが進行中である。
- 究極に無害なタンパク質は何か? その究極的な大量発現は何を引き起こすのか?
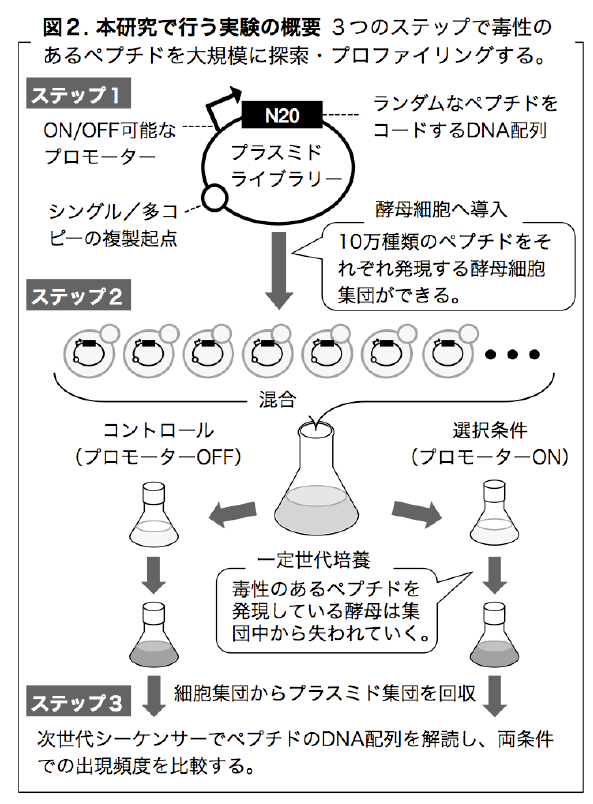
- 連続するアミノ酸(polyX)がもつ毒性
- 出芽酵母のすべてのタンパク質の限界発現量を測る(gTOW2.0)
これらは現在、さらに難しげな言葉で説明される概念へと発展しており、それを説明するために最近の基盤Bの申請において、「発現量を決める進化原理の概念モデル」が登場した。これもまたどこかで解説することになるだろう。